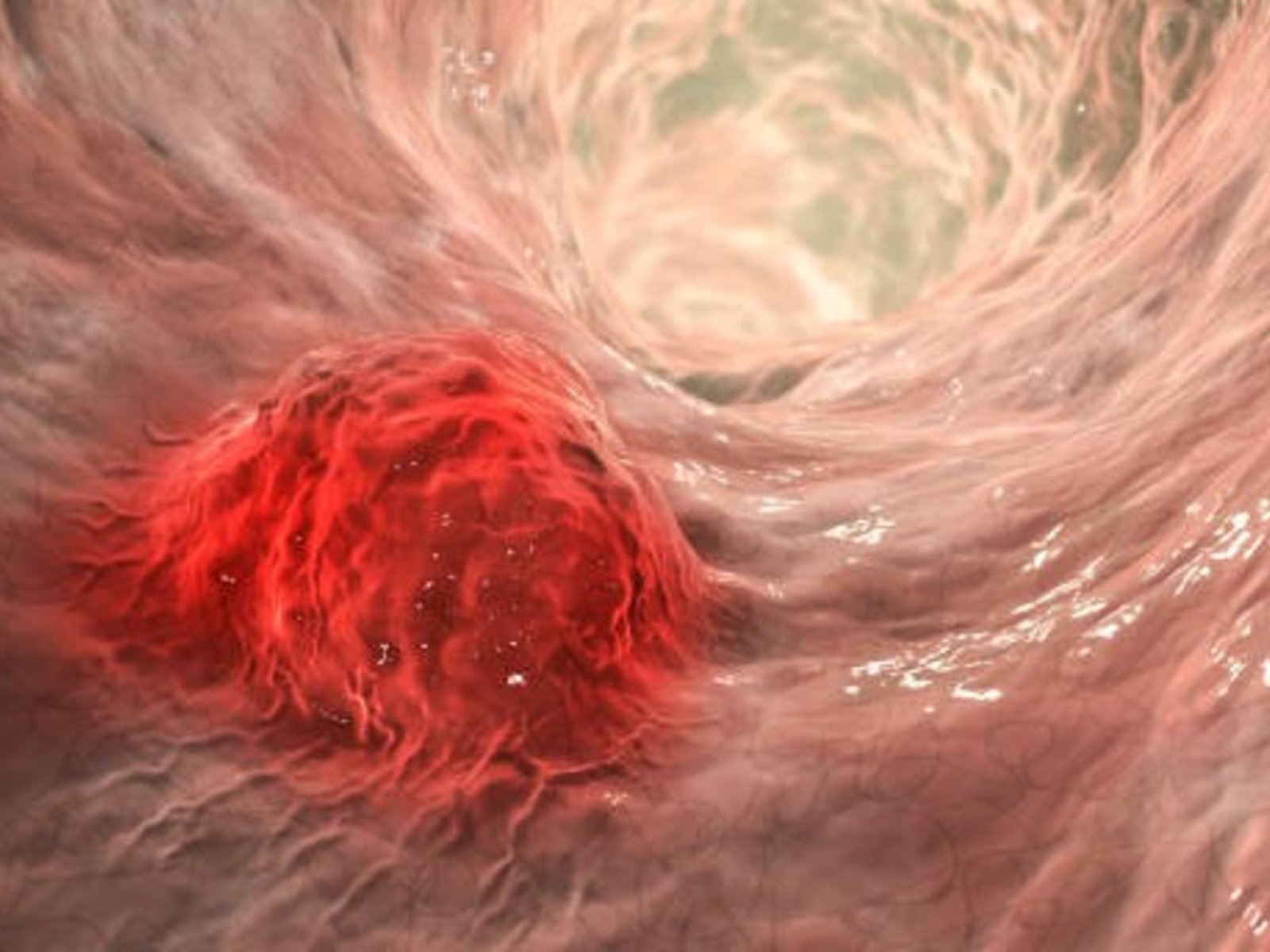
Cada año, 16.000 personas reciben un diagnóstico de cáncer colorrectal (CCR) en Argentina. Esta enfermedad representa el segundo tipo de cáncer con mayor incidencia en nuestro país y el segundo que provoca mayor mortalidad (se registran más de 7.500 fallecimientos por año). Después del cáncer de pulmón, genera cerca del 12% de los fallecimientos a nivel nacional.
Las cifras reflejan el peso sanitario de la enfermedad: los expertos hablan de una incidencia moderada/alta de cáncer colorrectal en el país. De hecho, después de Uruguay, Argentina lidera el ranking regional: ambos exponen las tasas más altas de casos y de mortalidad por CCR.
Aunque el ranking mundial todavía está encabezado por varios países europeos (como Hungría, Eslovaquia y Noruega), Uruguay y Argentina se ubican en el top 10-15, según la tasa ajustada por edad. Así lo grafica GLOBOCAN 2022, los últimos datos disponibles en esta base global de la Agencia Internacional de Investigación del Cáncer de la Organización Mundial de la Salud.
¿Por qué Argentina y Uruguay representan los dos “picos” sudamericanos? “Ambos países encabezan el consumo per cápita de carne roja y procesada. Es curioso, pero los países con un índice de desarrollo humano alto concentran más cáncer colorrectal: es la ‘factura’ del combo dieta-vida urbana. La carne por sí sola no explica todo, pero es la ‘punta del iceberg’ de un patrón dietario y de vida que favorece este tumor”, analiza Mariano Dioca, médico oncólogo del departamento de tumores digestivos del Instituto Angel Roffo, en diálogo con Clarín.
Apunta que estudios locales muestran un aumento del riesgo de hasta 30-40% con ingestas altas de carne, y menciona que otros factores de “estilo occidental” son la obesidad, el sedentarismo, el consumo de alcohol y de tabaco que le suman puntos al riesgo. También influye la expectativa de vida: es que el tamizaje, las poblaciones más longevas, la mayor cantidad de colonoscopías y los mejores registros elevan la cifra absoluta de casos detectados.
Enfermedades de origen hereditario
El cáncer colorrectal comienza con una proliferación de células (pólipos) que se forman en el intestino grueso. Si bien suelen ser benignos, pueden evolucionar de manera gradual cuando no se identifican ni eliminan oportunamente.
En este escenario, el 80% de los pacientes con CRR presentan un origen esporádico, es decir, ocurren sin un síndrome hereditario claro y a veces sin historia familiar. Y alrededor del 20% muestra un patrón familiar (uno o varios parientes de primer grado afectados), pero sin mutación germinal identificable: sólo entre un 5 y un 10% obedecen a síndromes hereditarios definidos.
¿Cuáles son las enfermedades hereditarias más frecuentes que originan este tipo de cáncer? El síndrome de Lynch y la poliposis adenomatosa familiar (PAF).
En este punto es necesario aclarar que la principal diferencia entre un cáncer hereditario y genético (esporádico) radica en el origen de la predisposición a esta patología: el primero es causado por mutaciones genéticas que están presentes desde el nacimiento. Y el segundo engloba a todos los tipos de cáncer de colon que se refieren a la genética molecular de cada tumor, que los diferencia y hace que a algunos pacientes se los trate de una manera y a otros, de otra (la llamada medicina de precisión).
¿En qué consisten? El síndrome de Lynch es un trastorno hereditario que aumenta el riesgo de tener cáncer, especialmente de colon y de útero, pero también puede dar en otros órganos como estómago, ovarios o, incluso, el cerebro. Se produce por una falla en los genes que reparan errores del ADN, como si el cuerpo tuviera menos capacidad para “corregir tipeos” genéticos.
“No todas las personas con este síndrome van a desarrollar cáncer, pero el riesgo es mucho mayor que en la población general. Suele detectarse a edades jóvenes (antes de los 50) cuando en una familia hay varios casos de cáncer de colon o útero”, explica Juan Manuel O’Connor, jefe del área de tumores gastrointestinales del Instituto Alexander Fleming.
En cuanto a la poliposis adenomatosa familiar (PAF), refiere que se trata de una enfermedad hereditaria rara que puede ser muy agresiva si no se trata.
“Se caracteriza por la aparición de cientos o miles de pólipos (pequeños bultitos) en el colon desde la adolescencia. Si no se opera, casi el 100% de las personas con PAF desarrollan cáncer de colon antes de los 40-45 años. La solución es quirúrgica: suele recomendarse sacar el colon (colectomía) antes de que aparezca el cáncer. Después, con controles, la persona puede hacer su vida normal”, amplía.
Mutaciones genéticas
El CCR es una enfermedad de comportamiento heterogéneo y su origen puede también estar asociado a distintas mutaciones genéticas (un cambio en la secuencia del ADN). Las más agresivas son BRAF (un gen que proporciona instrucciones para producir una proteína que regula el crecimiento y la división celular), KRAS Y NRAS.
La primera es la que tiene peor pronóstico y es una de las más comunes en los casos de CCR metastásico: representa el 10% y no suele responder bien a la quimioterapia estándar.
Por otro lado, entre el 48 y el 50% porta mutaciones en los genes KRAS o en NRAS. “Cuando están presentes tienen mayor agresividad y menores oportunidades de tratamiento sin tener el nivel de agresividad de BRAF”, dice Dioca. Y agrega que el índice en estas últimas es mayor porque suele ser una característica inherente al tumor y todavía no hay una terapia dirigida, excepto para una mutación específica de KRAS.
En materia de tratamiento, la novedad es una nueva indicación terapéutica (el primer y único régimen combinado con terapia dirigida), que ya fue aprobada por la Administración Nacional de Medicamentos, Alimentos y Tecnología Médica (ANMAT) y que puede mejorar significativamente los resultados de supervivencia en pacientes sin tratamiento previo con este subtipo específico de cáncer colorrectal metastásico.
La droga se denomina encorafenib y está indicada en combinación con cetuximab y quimioterapia, para el tratamiento en primera línea de pacientes adultos con cáncer colorrectal metastásico con una mutación genética específica llamada BRAF V600E. ¿Cómo actúa? Inhibiendo la acción de una vía (MAPK) responsable de estimular el crecimiento y la proliferación de células tumorales.
Según datos recientes que se presentaron en la Reunión Anual 2025 de la Sociedad Americana de Oncología Clínica (ASCO) y simultáneamente en el New England Journal of Medicine, el ensayo de fase III mostró que esta terapia logra una reducción del 51% en el riesgo de muerte en comparación con el tratamiento estándar y del 47% en el riesgo de progresión de la enfermedad.
Prevención y tratamiento
El cáncer colorrectal es prevenible y puede tener buen pronóstico si es detectado en forma temprana, pero más del 50% de los casos se diagnostican en un estadio metastásico. Es que el aumento de la probabilidad de curación y la reducción del riesgo de recurrencia depende de la etapa en que se advierta la enfermedad y no está dada por la edad del paciente (sólo podría incidir en el retraso del diagnóstico).
Esto último merece un párrafo aparte. Es que si bien la mayoría de los diagnósticos se presentan en adultos de 50 años o más, se está observando un incremento progresivo de casos en adultos cada vez más jóvenes y existen muchos prejuicios o limitaciones sobre los estudios de rutina – como la colonoscopia o las pruebas en heces fecales – que dificultan la detección temprana y hacen que, aún hoy, su índice de mortalidad sea alto: en Argentina, cerca del 20% se hace un estudio como parte de un tamizaje.
Así, en un estadio 1 (cuando el tumor no perforó más de dos capas de la pared del intestino) la chance es del 90%; en un estadío 2 (cuando perforó tres capas) ronda entre el 75% y 80%; en un estadío 3 (cuando compromete a ganglios locales) disminuye al 40% o 50%; y en una fase 4 (cuando hay metástasis) cae drásticamente al 10%, ilustran las fuentes consultadas.
“En resumen, el tratamiento se ha vuelto cada vez más ‘a la carta’: los biomarcadores (RAS, BRAF, MSI, HER2, ctDNA) determinan la receta exacta. La inmunoterapia cambió el juego en los tumores dMMR y las terapias dirigidas contra BRAF y HER2 ya son parte del arsenal estándar. Hoy, hay varios tipos de tratamientos: desde la cirugía, hasta la radioterapia, la quimioterapia y las denominadas terapias blanco o dirigidas según biomarcadores”, coinciden Dioca y O’Connor.
Sin dudas, los avances en el área de la medicina de precisión y el conocimiento molecular han mejorado las posibilidades de tratamiento actual, seleccionando adecuadamente el tratamiento indicado para cada paciente.